三氟甲烷或氟仿是一种无色不可燃气体,分子式为CHF3..顾名思义,它属于卤素类(氟、氯等卤素原子取代甲烷的氢原子的一类化合物)。
1894年,法国药剂师和化学家莫里斯·梅斯兰(Maurice Meslans)第一个通过碘仿和干氟化银反应获得氟仿。然而,它是由氯仿(CHCl3.)和氟化氢(HF),并且是制造特氟龙等化学品的副产品或前体。
氟仿是一种强有力的温室气体,但不会造成臭氧层的损耗。它有多种应用,如制冷剂、灭火剂、聚合物中间体等。
在本文中,我们将讨论与CHF相关的一些搜索最多的问题3.包括它的路易斯点结构,几何,杂交和极性。
| 化合物名称 | 铍碘化 |
| 化学公式 | 瑞士法郎3. |
| 熔点 | 118 K |
| 沸点 | 191.1 K |
| 价电子的总数 | 26 |
| 键的性质 | 共价 |
| CHF3的分子几何结构 | 四面体 |
| CHF3的电子几何结构 | 四面体 |
| 杂交 | Sp3. |
| 极性 | 极地 |
CHF3的Lewis点结构
路易斯点结构表示分子原子的价电子,可以是孤电子对,也可以是键内电子。CHF的Lewis点结构3.含有一个中心碳原子,三个氟原子和一个氢原子作为末端原子。
CHF3 Lewis点结构的绘制步骤
步骤1:计算CHF3的价电子总数:
三氟甲烷包含四个原子——一个碳原子,一个氢原子和三个氟原子。要知道原子的价电子(直到原子序数20),记住它的元素周期表的基团号。
例如,氢是1圣所以它的价电子是1
碳属于14th所以,它的价电子是4
氟在17号碳上th所以,它的价电子是7
CHF中可用的价电子总数3.= 4 + 1 + 7 (3) = 26
步骤2:选择路易斯点结构的中心原子:
分子中电负性最小的原子(氢除外)可以表示为路易斯点结构中的中心原子。
以CHF为例3.碳的电负性比氟小,因为在周期表中,电负性从左到右增加,所以把碳作为中心原子,与一个氢原子相连,三个氟原子作为周围原子。
第三步:通过单键连接外层原子和中心原子:
画出CHF的骨架分子3.通过单键将所有外部原子与中心位置的碳原子连接起来。所以这个结构中形成的键的总数是4个。

每个单键代表共用两个电子,所以这个结构中使用的价电子数是4 ×2 = 8个电子。
剩余价电子数:26 - 8 = 18价电子
第四步:将剩余价电子排列成八隅体:
八隅体规则指出,一个原子的最外层必须有8个电子,才能变得像惰性气体那样稳定。
开始将剩余的价电子从外层原子排列到中心原子,以完成八隅体。
氢原子已经通过单键共用了两个电子。这样,它的最外层就被填满了。所以氢原子周围不需要电子
每个氟原子还通过单键共用两个电子。这样,它只需要6个电子来完成它的八隅体所以每个氟原子周围有6个电子
碳已经通过4个单键共用了8个电子。这样,它的最外层就被填满了。所以,碳原子周围不需要电子

第五步:计算每个原子的形式电荷来检验稳定性:
形式电荷决定了路易斯点结构的稳定性。形式电荷越小,结构的稳定性越高。
计算公式:
形式电荷=中性原子中的价电子-孤对电子- 1/2成键电子
碳原子的形式电荷:
碳的价电子为4
碳上的孤对电子= 0
碳原子周围的成键电子对(用单键表示)= 8
碳原子的形式电荷:4 - 0 - 8/2 = 0
氢原子的形式电荷:
氢的价电子为1
氢上的孤对电子= 0
氢原子周围的成键电子对(表示为单键)= 2
氢原子的形式电荷:1 - 0 - 2/2 = 0
每个氟原子的形式电荷:
氟的价电子是7
氟原子上的孤对电子(用点表示)= 6
氟原子周围的成键电子对(用单键表示)= 2
每个氟原子的形式电荷:7 - 6 - 2/2 = 0
在这个结构中,所有原子的形式电荷都是零,这就是CHF的稳定路易斯点结构3..
CHF3几何
价电子对斥力(VSEPR)是一种预测分子几何结构的模型。它的主要思想是分子将根据价电子层中电子对的排斥力来决定其几何形状。
电子总是倾向于以一种方式排列自己,使它们之间的距离保持最大,它们之间的斥力保持最小,以使排列稳定。
价层电子之间的排斥性相互作用顺序如下:
孤对(lp) -孤对(lp)˃孤对(lp) -键对(bp)˃键对(bp) -键对(bp)
确定CHF几何形状的步骤3.利用VSEPR理论
•修改CHF的Lewis结构3.
•计算中心原子周围成键电子和孤对电子的数量
•根据其分子类型或VSEPR符号(表示为AB)预测几何形状nE米,其中A为中心原子,B为中心原子n为键对数,E米表示孤对的数量)。
注:双键、三键等多重键只算一个键对
在CHF3的Lewis结构中,碳是中心原子,它有4个单键(4个电子)和0个孤对。所以VSEPR符号变成了AB4Eo或AB4.
根据下面的VSEPR表,CHF的几何形状3.为四面体,键角为109.5⁰。
表1给出了中心原子上没有孤对的分子的几何形状:

表2显示了中心原子上有一个或多个孤对的分子的几何形状

CHF3杂交
在化学中,杂化是原子轨道能量重新分配以形成新的杂化轨道的概念。
杂交的一些主要特征包括
•具有相同能量的原子轨道参与杂化
杂化轨道的数量等于参与的原子轨道的数量
杂化只发生在键的形成过程中
•它可以是多种类型,如sp, sp2, sp3., sp3.d sp3.d2根据参与原子轨道的数量
参与轨道的数量可以计算为
•½(附在中心原子上的单价原子数+中性中心原子的价电子数)
或
•中心原子的sigma键数+中心原子上孤对数
| 包含轨道数 | 杂交 |
| 2 | Sp |
| 3. | Sp2 |
| 4 | Sp3 |
| 5 | Sp3d |
CHF3的杂交
在瑞士法郎3.,中心原子上的单价原子数= 4
中性中心原子的价电子数= 4
由上式,参与轨道数为:½(4 + 4)= 4 = sp3.杂交
换句话说,它可以理解为碳的原子序数:6
电子构型= 1s22 s22 px22 py02 pz0
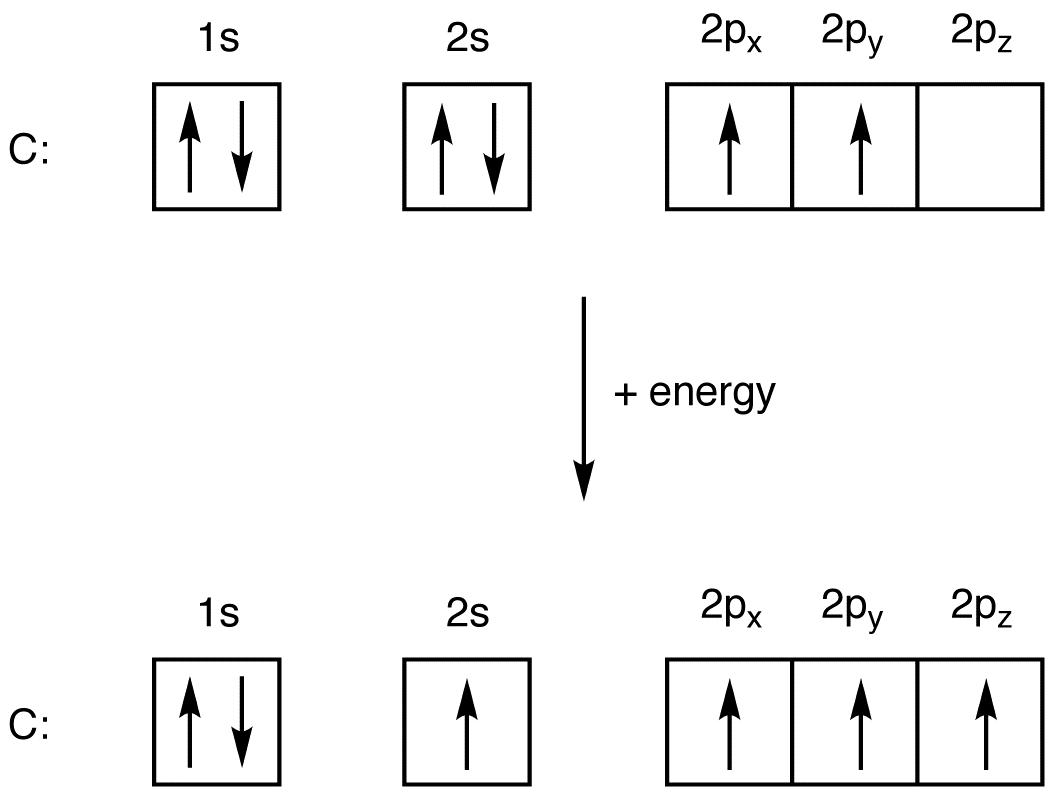
当碳原子被激发时,它的电子从2s轨道移动到2p轨道(2s和2p有相似的能级)。它是1个s轨道和3个p轨道混合形成4个sp3杂化轨道。

氢的原子序数是1
氢的电子排布为1s1
氟的原子序数是9
氟= 1s的电子构型22 s22 px22 py22 pz1
氢和氟分别在1s和2p轨道上有一个未成对电子,这些未成对电子与每个sp成键3.杂化轨道。
CHF3极性
氟的电负性比碳强所以在碳氟键中,氟把电子拉向自己。在碳氢键中,碳比氢的电负性更强,前者把电子拉向自己。
作为电负性最强的分子,氟作为分子的负极,而氢作为分子的正极。因此,CHF3具有非零偶极矩。CHF3是极性分子。

CHF3的极性取决于
电负性
当原子间的电负性差增大时,极性增大。在CHF3的情况下,氟的电负性为3.98,而碳的电负性为2.6。
氟和碳之间电负性的差异导致原子周围电荷的不对称分布。
分子的几何或形状
不对称结构在本质上通常是极性的。CHF3具有四面体几何结构,本质上是不对称的,因此被认为是极性的。
相关的话题
结论
氟仿是一种卤仿,化学式为CHF3。它是一种强有力的温室气体,但不会造成臭氧消耗
CHF3的Lewis结构有26个价电子,其中18个是孤对电子,8个是键对电子。
CHF3有4个键对和0个孤对,因此根据VSEPR理论,它具有109.5度键角的四面体几何结构
CHF3杂化为sp3,其中1个s轨道和3个p轨道杂化在一起形成4个sp3杂化轨道
CHF3由于原子的电负性不同,结构不对称,是极性分子。CHF3的偶极矩为1.8 D。
阅读快乐! !




